Real–Time PCR و ملاحظات ایمنی آن
Real–Time PCR و ملاحظات ایمنی آن: هر کسی که در آزمایشگاه کار میکند باید از قانون استاندارد ایمنی آزمایشگاه تبعیت کند. این موارد شامل این میشود که چطور درست مواد شیمایی خطرناک برق را بهطور ایمن استفاده کند. و فضای کار آزمایشگاه را به دور از بههمریختگی نگه دارد تا احتمال حادثه را کاهش دهد. برخی از مواد شیمایی که در زیستشناسی مولکولی استفاده میشوند، میتوانند خطرناک باشند. مهم است که هر کس که در آزمایشگاه کار میکند از اطلاعات ارائهشده در برگههای اطلاعات ایمنی مواد (MSDS) آگاه باشد.
تمام تولیدکنندگان مواد شیمیایی خطرناک از نظر قانونی موظفاند که به استفادهکننده برگههای MSDS را که اطلاعات مقتضی در مورد خطرهای مرتبط با مواد شیمایی را شرح میدهد، ارائه میدهند. بهطور کلی، در هنگام کار کردن در آزمایشگاه، باید روپوش آزمایشگاه، دستکش و محافظ چشم پوشیده شود.
ملاحظات-ایمنی
ملاحظات ایمنی تکنیک Real–Time PCR
۱- قابلتوجهترین ماده شیمیایی در حین آزمایش Real–Time PCR، اتیدیوم بروماید است. اتیدیوم بروماید یک ماده سرطانزاست و باید با دقت استفاده شود. همانطور که در برگه MSDS یا با روشی که توسط مسئول ایمنی آزمایشگاه شرح داده میشود، دور ریخته شود.
۲- مورد خطرناک دیگر که در این بخش بحث میشود، نور ماوراء بنفش (که برای ژلهای آگارزی که دارای اتیدیوم بروماید هستند، استفاده میشود) و برق است. نور ماوراء بنفش میتواند باعث ناراحتی حاد چشم شود. چشم انسان نمیتواند در معرض قرار گرفتن زیاد را تشخیص دهد و باید همیشه محافظ چشم مناسبی را استفاده کرد (عینک ایمنی نگهدارنده UV). ولتاژ استفادهشده برای الکتروفورز آگارز آنقدر هستند که اگر درست بکار گرفته نشوند، باعث برقگرفتگی شوند. درست به کار گرفتن یعنی پوشاندن مخزن بافر در طی الکتروفورز و خاموش کردن منبع برق و جدا کردن سیمهای رابط قبل از برداشتن ژل.
روش های انجام تکنیک Real–Time PCR
تکنیک Real–Time PCR نیاز به ارتباط دادن دو مرحله به هم دارد. این دو، به ۲ روش پایه مختلف تفکیک میشوند:
-
روش پایه ۱
تبدیل RNA استخراجشده به cDNA توسط آنزیم نسخهبرداری معکوس است.
-
روش پایه ۲
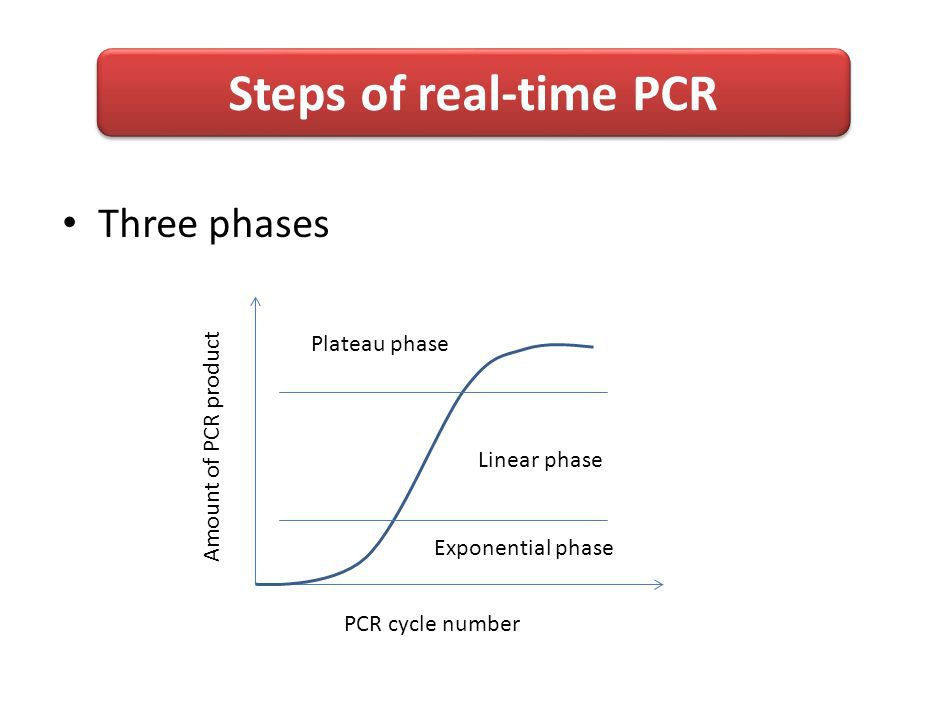
تکثیر PCR زمان واقعی و تجزیه و تحلیل بعدی آن را شرح میدهد. سه روش وجود دارند که در تجزیه وتحلیل واکنش Real–Time PCR به کار گرفته میشوند:
۱- اولین و اساسیترین مرحله در واکنش Real–Time PCR بدست آوردن RNA کل سالم، باکیفیت بالا و بدون آلودگی RNases است. RNA ناخالص یا شکسته شده میتواند بازده واکنش RT و محصول cDNA را کاهش دهد. تعداد زیادی روش برای خالصسازی RNA از سلول یا بافتها وجود دارد. گرچه که کیتهای بسیاری بهصورت تجاری برای خالصسازی RNA امکان استخراج سریع RNA را میسر میکنند و نیاز به فنل را در مرحله خالصسازی حذف میکنند.
اما روش ترجیحی از تکنیک استخراج یک مرحلهای فنل-گوانیدیوم تیوسیانات کلروفورم است که توسط چامسزینسکی و ساکی (Chomczynski and Sacchi) در سال ۱۹۷۸ ابداع شد. توصیه میشود که پیش از شروع کردن استخراج RNA، اطلاعات مربوط به جزئیات استخراج RNA و خالصسازی آن را مرور کند. بهطورکلی، این مرحله، بسته به تعداد نمونهها بین ۳۰ تا ۶۰ دقیقه نیاز دارد.
روش-Real–Time PCR
۲- دومین مرحله، ساخت cDNA است که بسته به تعداد نمونهها بین ۹۰ تا ۱۲۰ دقیقه زمان نیاز دارد. خالصسازی mRNA (یا Poly A+ RNA) نیاز به مراحل و زمان اضافه دارد و در اینجا بحث نمیشود.
۳- یک مرحله اضافه و گاهی اساسی پیش از نسخهبرداری معکوس، حذف DNA ژنومی آلودهکننده است. این مرحله نیاز به اینکوبیت کردن RNA با DNase بدون RNase، پیش از RT-PCR دارد. سپس RNA باید دوباره خالص شود تا آنزیم DNase آلودهکننده حذف شود. این مرحله را میتوان با طراحی مناسب آغازگرها حذف نمود. چنانچه پیشتر توضیح داده شد یعنی اینترون را straddle کرد، بهطوریکه آغازگر نتواند ساخت هدف را از DNA ی ژنومی معادل آن آغاز کند. زمانی که RNA با موفقیت خالصسازی شد، بلافاصله یا باید ابتدا استفاده شود یا باید در ۸۰- درجه سانتی گراد ذخیره شود تا از تجزیه خود کاتالیتیکی آن جلوگیری شود.
Real–Time PCR و ملاحظات ایمنی آن
-
نکات
روشهای RT-PCR از دستورالعمل چندین سازنده تجاری کیتهای در دسترس جمعآوریشدهاند و بر اساس تجربههای نگارنده تغییر دادهشدهاند. در کل، مواد همه سازندگان که با ترمال سایکلر مورداستفاده همخوانی دارند، قابل استفاده هستند. برای نمونه DNA Engine Opticon system (Bio-Rad) به تیوبهای low-profile سفید و دربهای شفاف برای استفاده در دستگاه، نیاز دارد. معمولاً استفاده کردن از ردیفهای تیوبهای هشتتایی یا پلیت هایی که با تعداد زیاد نمونهها سروکار دارند، راحتتر است.

ملاحظات-ایمنی- Real–TimePCR
جمع بندی مراحل تکنیک Real–Time PCR
- روش پایه ۱: ساخت cDNA توسط نسخهبرداری معکوس
- روش پایه ۲: تکثیر PCR زمان واقعی و تجزیه و تحلیل آن
- روش پشتیبانی ۱: تعیین بازده تکثیر
- روش پشتیبانی ۲: تجزیه نتایج با استفاده از روش فافل برای محاسبه Fold Induction
- روش پشتیبانی ۳: سریال رقت برای منحنی استاندارد










دیدگاهتان را بنویسید